Физические свойства |
|
Скачать презентацию |
||
| << Нахождение кислот в природе | Правила техники безопасности при работе с кислотами >> |
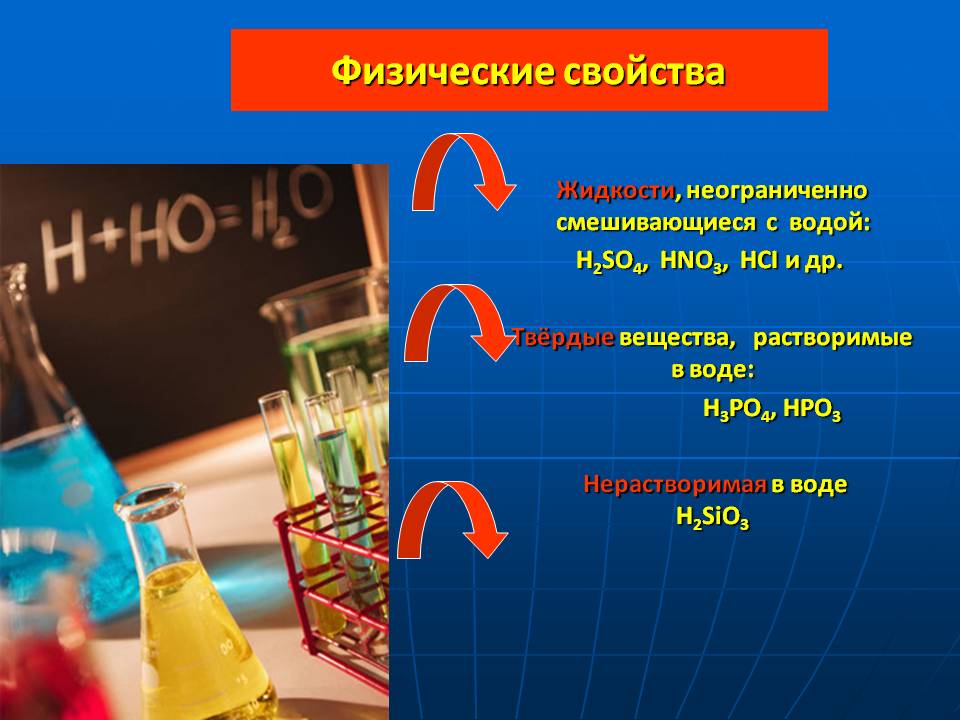
Физические свойства. Жидкости, неограниченно смешивающиеся с водой: H2SO4, HNO3, HCI и др. Твёрдые вещества, растворимые в воде: H3PO4, HPO3 Нерастворимая в воде H2SiO3.
Скачать презентацию
Химия 8 класс
краткое содержание других презентаций«Уравнение окислительно-восстановительной реакции» - Уравнения окислительно- восстановительных реакций. Как по уравнению можно определить окислительно- восстановительную реакцию. Окислитель. Реакции круговорота веществ в природе. Опусти меня в раствор, в медный купорос. Уравнение. Основные понятия. Косметология. Окислительно-восстановительные реакции в природе и жизни человека. Оптимальный вариант. Фотосинтез. Укажите окислительно- восстановительные реакции.
«Свойства кислот» - Основный оксид + кислота = соль + вода. Бескислородные HF, H Cl, H Br, HI H2S. Лакмус. Взаимодействие кислот с основными и амфотерными оксидами. Взаимодействие кислот с металлами. Некоторые кислоты разлагаются при н.у. или при нагревании: Что такое кислоты? Муравьи, защищаясь от врагов, разбрызгивают капельки муравьиной кислоты. Взаимодействие кислот с основаниями. Кислородсодержащие HNO3, HNO2 H2SO4 , H2SO3 H2CO3, H2SiO3 H3PO4.
«История химии как науки» - Биохимия. Берцелиус. Больцман. Бертло. Органическая химия. Достижения алхимии. Ятрохимия. Бекетов. Алхимия. Новые методы исследования. Бойль . История химии. Пневматическая химия. Аррениус. Структурная химия. Авогадро. Атомная теория. Бор. Техническая химия. Великие ученые – химики. Греческая натурфилософия. Промышленная химия.
«Получение водорода» - Производство минеральных удобрений. Природный газ. Способы получения. Допиши химические реакции. Получение водорода в промышленности и его применение. Типы реакций. Нагревание. Применение водорода. Способы получения водорода. Получение водорода в промышленности.
«Атомы химических элементов» - Формулировка Периодического закона. Определить состав атомов. Атом. Формы атомных орбиталей. Вставьте пропущенные слова. Относительные молекулярные массы. Энергетическая диаграмма. Схемы распределения электронов. Порядковый номер химического элемента. Атомы химических элементов. Фундаментальные открытия. Изотопы. Химический элемент. Строение атома железа. Строение электронных оболочек атомов. Электронная конфигурация атомов.
«Количество вещества, моль» - Количество сахарозы. Можно ли найти массу, зная количество вещества. Количество вещества. Найти массу 3 моль атомов серы. Молярная масса . Множество. Число Авогадро. Число частиц в одном моль вещества. Количество. Масса. Равные массы. Сформировать понятие о количестве вещества. Число частиц. Количественные измерения в химии. Сахара. Знания. Моль вещества. Физические величины. Объем. Порции. Моль. M/M.
Всего в теме «Химия 8 класс» 53 презентации