Взаимодействие серы с водородом |
|
Скачать презентацию |
||
| << Химические свойства серы | Взаимодействие серы с кислородом >> |
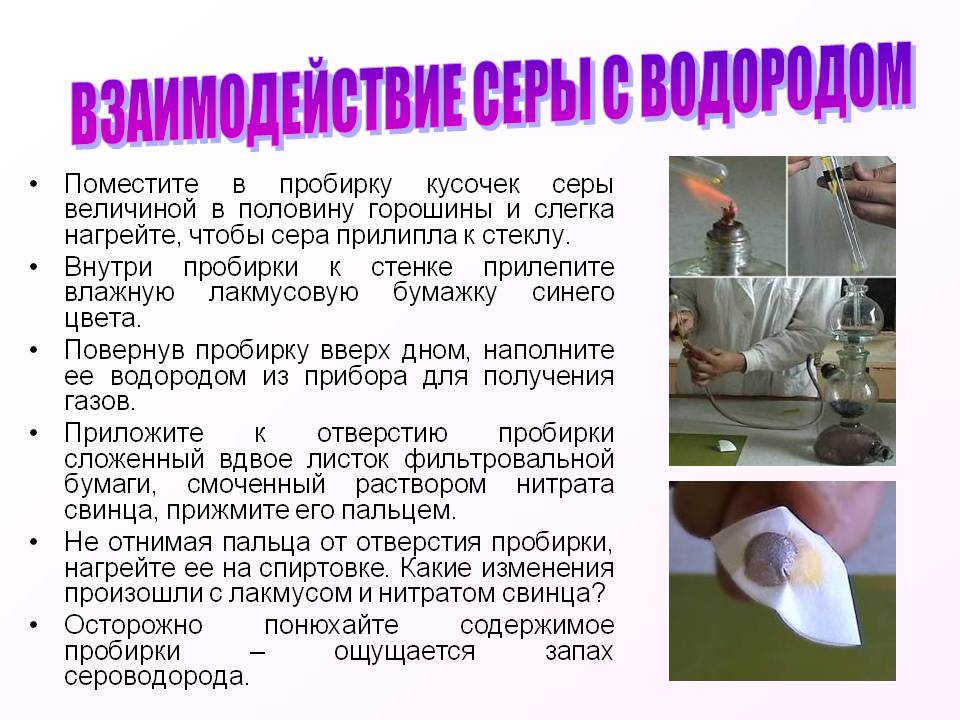
Взаимодействие серы с водородом. Поместите в пробирку кусочек серы величиной в половину горошины и слегка нагрейте, чтобы сера прилипла к стеклу. Внутри пробирки к стенке прилепите влажную лакмусовую бумажку синего цвета. Повернув пробирку вверх дном, наполните ее водородом из прибора для получения газов. Приложите к отверстию пробирки сложенный вдвое листок фильтровальной бумаги, смоченный раствором нитрата свинца, прижмите его пальцем. Не отнимая пальца от отверстия пробирки, нагрейте ее на спиртовке. Какие изменения произошли с лакмусом и нитратом свинца? Осторожно понюхайте содержимое пробирки – ощущается запах сероводорода.
Скачать презентацию
Химия 9 класс
краткое содержание других презентаций«Химия Алюминий» - «Серебро из глины». История открытия. Алюминий. Выполнила: учитель химии Евстегнеева Алевтина Васильевна. МБОУ – Раздольненская средняя общеобразовательная школа №19 Новосибирского района Новосибирской области. Получение алюминия (химический способ). Впервые получил алюминий промышленным способом (1855г.). Относится к группе лёгких металлов. с. Раздольное - 2011. Физические свойства. Чашка из алюминия стала дороже золотой. 2e-, 8e-, 3e-. ПРЕЗЕНТАЦИЯ ПО ХИМИИ ДЛЯ УЧАЩИХСЯ 9 КЛАССОВ НА ТЕМУ: «Алюминий».
«9 класс Алюминий» - AL. 3.С основаниями. 2AL+6HCL=2ALCL3 +3H2. Амфотерность алюминия. Химические свойства алюминия. Физические свойства алюминия. Положение алюминия в периодической системе Д.И.Менделеева. 4AL +3O2 =2AL2O3. 2AL+ 2NaOH + 2H2O=2NaALO2 +3H2. Урок химии в 9 классе по теме «Алюминий». С серной и азотной концетрированными не реагирует. Металлы. 4.С оксидами металлов (алюминотермия). 2.С кислотами ( с серной и соляной (разбавленной).
«Неметаллы» - РЯД ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ НЕМЕТАЛЛОВ. Положение в ПСМ. Жидкое Бром. Примеры: Алмаз – графит ( крист. Химические свойства неметаллов. Газообразное Кислород, водород. Химия 9 класс Учитель Кулешова С.Е. Чем объясняется разнообразие агрегатного состояния неметаллов. Физические свойства. Агрегатное состояние. Решетка) Красный фосфор – белый фосфор (строение молекулы Р2 и Р4). Тест. Назовите самые активные и сильные неметаллы. Кислород О2 и Озон О3. Твердое Углерод кремний. Как вы думаете, в таблице больше металлов или неметаллов?
«Характеристика металлов» - Другие металлы коррозируют, но не ржавеют. Общая характеристика металлов. Ржавление и коррозия металлов. Многие металлы широко распространены в природе. Железо. Металлы составляют одну из основ цивилизации на планете Земля. Свойства металлов. Нахождение металлов в природе. К металлам относятся примерно 70 % всех химических элементов. Металлический блеск. Большое количество натрия и магния содержится в морской воде: — 1,05%, — 0,12%.
«Железо и сталь» - Железо сегодня – важнейший металл цивилизации. Сварочное железо и литая сталь. Все основные современные процессы производства чугуна и стали исходят из Англии. Железо сегодня и завтра. Но вскоре чугун научились заливать в формы. Кельты создали новые технологические процессы обработки железа.
«Развитие органической химии» - Фигуровский Н.А. История химии. Практикумы. Тема №3. Знания об органических веществах с древности до 18 века. Азимов А.Н. Краткая история химии. Лабораторные опыты. Отчёт об исследовании. Дискуссии. Программа курса. Доклады, рефераты. Семинары. Быков Г.В. История органической химии. Тема №4. Формы и методы контроля. Задачи. Презентация. Тематическое планирование. Результаты работы. Соловьёв Ю.И. История химии: развитие химии с древних времён до конца 19 века.
Всего в теме «Химия 9 класс» 94 презентации