Расставьте Н согласно валентности |
|
Скачать презентацию |
||
| << Соли | Какие металлы не реагируют с кислотами >> |
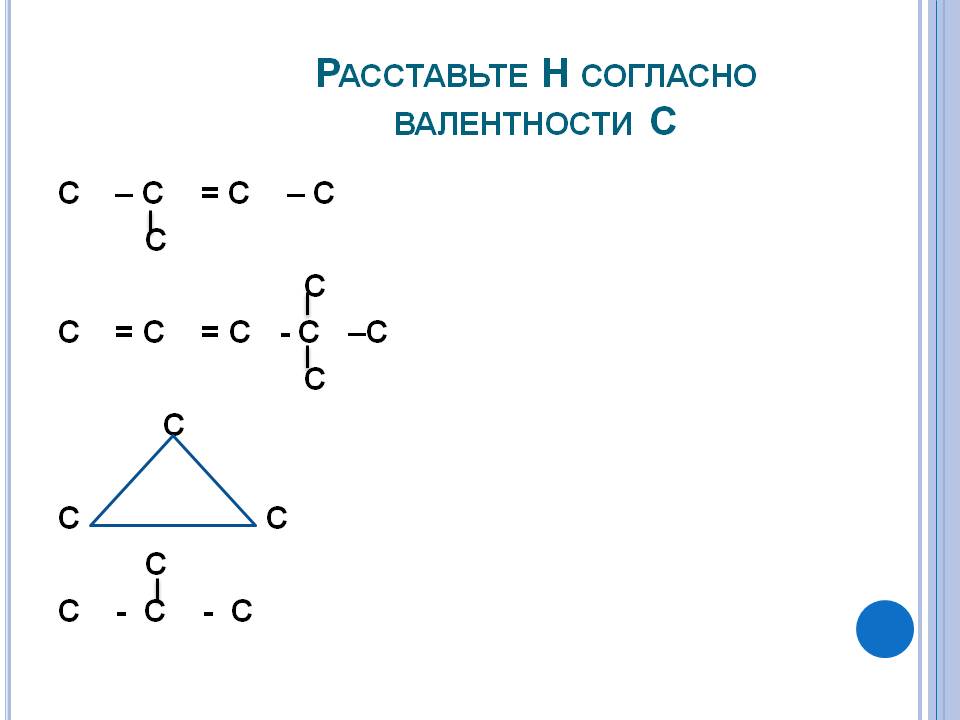
Расставьте Н согласно валентности С. С – с = с – с с с с = с = с - с –с с с с с с с - с - с.
Скачать презентацию
Химия 9 класс
краткое содержание других презентаций«Общая характеристика металлов» - Физика. Химия. Знания учащихся по химии. Оперирование знаниями. Удивительный мир металлов. Уровень овладения знаниями. Калейдоскоп. История. Мыслящий ум. Биология.
«Кислород. Озон. Воздух» - М.В.Ломоносов. Получение кислорода. Выделение кислорода. Обобщение. Проверьте ваши ответы. Биологическая роль. Лабораторный опыт. Кислород. Выполните тест. Состав воздуха. Аллотропия. Решите проблему. Изучить состав воздуха. А.Лавуазье. Применение кислорода. Озон и кислород. Выполните задание. Свойства кислорода.
«Понятие металлов» - Найдите третье лишнее вещество. С какой из данных солей не будет реагировать цинк. Составьте уравнения реакций. Найти соответствия. Главная характеристика. Отгадайте, о каком природном соединении идет речь. Решите задачу. Оксид натрия. Какой из данных элементов лишний. Полевые шпаты. Найдите все металлы. Составьте уравнение реакции. Гидроксид натрия. Неорганическая химия. Вставляем пропущенные понятия.
«Цемент» - Портландцемент. Водонепроницаемый безусадочный цемент. Водонепроницаемый расширяющийся цемент. Сульфатостойкий цемент. Разновидности цемента. Пластифицированный цемент. Гидрофобный цемент. Магнезиальный цемент. Цветной цемент. Пуццолановый цемент. Тампонажный цемент. Глиноземистый цемент. Белый портландцемент. Цемент. Шлаковый цемент. Белый цемент.
«Щелочные металлы и галогены» - Химические свойства щелочных металлов. Взаимодействие галогенов с водородом. Типичные основные оксиды. Цель урока. Сульфид. Урок химии для 9 класса. Значение К для организма. Функции. История открытия щелочных металлов. Сильные основания. Фтор - зеленовато-жёлтый газ, очень ядовит. К галогенам относятся фтор F, хлор Cl, бром Br, иод I , астат At. Галогены. Щелочные металлы. Лучшими натуральными источниками калия являются цитрусовые, томаты.
«Органические соединения железа» - Эссе. Получение. Техническое значение соединений железа. Век. Почему наш век можно назвать железным веком. Природные соединения железа. Бурый осадок. Качественная реакция на ион Fе3+. Зеленый осадок. Определите степени окисления железа. Cодержание металлов и неметаллов в организме человека. Применение стали. Генетический ряд железа. Булат. Качественная реакция. Реактив. Молекула гемоглобина. Cоединения железа.
Всего в теме «Химия 9 класс» 94 презентации