1) |
|
Скачать презентацию |
||
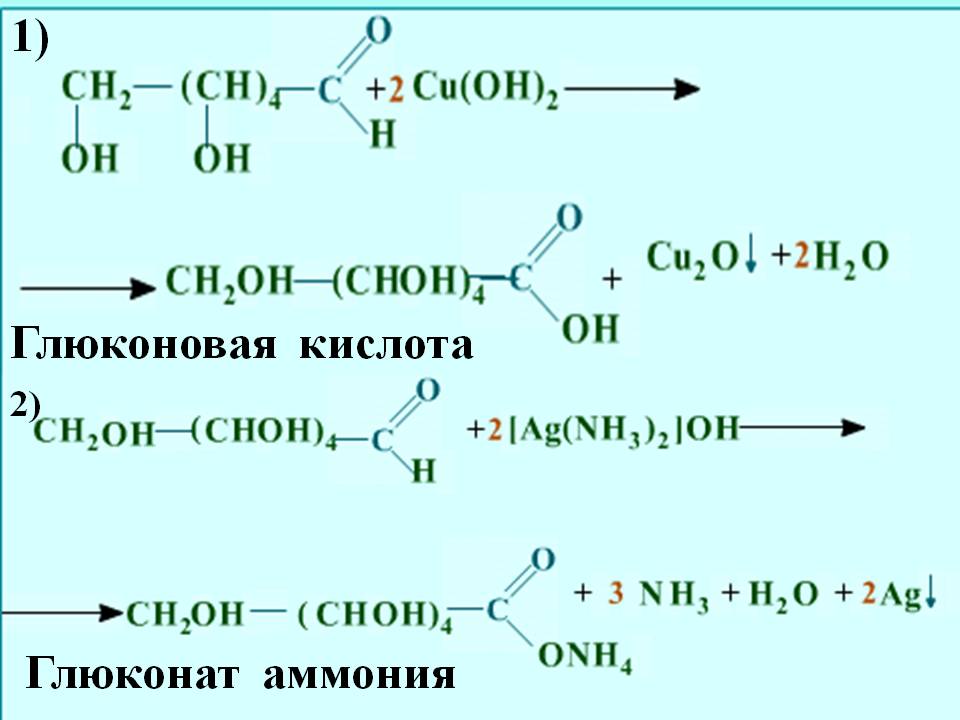
| << При действии на глюкозу слаб-и окислителями (свежеосажденным | Окисление альдегидной группы гидроксидом меди(2) >> |
Скачать презентацию
Химия 10 класс
краткое содержание других презентаций«Амины» - Применение аминов. Изопропиламин. Амины как основания. Образуя Амиды – важнейший класс органических соединений: Первичный амин метиламин Вторичный амин деэтиламин Третичный амин триэтиламин. Бутиламин. Третичный амин триметиламин. На воздухе с образованием углекислого газа, воды и азота: Третичный амин может ещё раз вступить в реакцию с бромэтаном. Амины взаимодействую с производными карбоновых кислот,(сложными эфирами, хлорагидридами, ангидридами). Ион этиламмония. Амид – является продуктом замещения гидроксильной группы на остаток амина.
«Роль химии» - Лекарства и яды. Как выделяется и запасается энергия в организме. Тема №3. Съедобное и несъедобное. Анальгетики, наиболее распространенные во врачебной практике. Химия волос. Искусственные органы. Тема №4. Наркотические вещества. Развитие фармацевтической химии. Авитаминоз, гиповитаминоз. О механизмах взаимодействия медицинских материалов с биологическими системами.
«Химия глюкоза» - План. Изменение в положении 1 приводит к образованию бета – глюкозы. Циклическая форма глюкозы - альфа-глюкоза. Окисление альдегидной группы гидроксидом меди(2). Сахароза, лактоза крахмал, целлюлоза -- подвергаются гидролизу с образованием моносахаридов. 2). Глюкоза. Углеводы. МОУ СОШ № 5 г. Светлого. 1). Пентозы, гексозы -- не подвергаются гидролизу. Глюконовая кислота.
«Генетическая связь» - Простые. Кислоты. CuCl2. Основания. Соль. HNO3. Б). Сумма всех коэффициентов равна. Соли. Сложные. 3. А). H3PO4. H2. Al(NO3)3. Na2O. Неметаллы. Какие классы веществ использовались? 2. H2O. Металл. Вещества. Найдите сумму ВСЕХ коэффициентов в уравнениях реакций.
«Кристаллы» - Оказалось, что кристалл рубина усиливает свет. В коллекциях Эрмитажа особым вниманием пользуются золотые украшения древних скифов. В земле вырастают кристаллы природных минералов. Однако драгоценные, красиво окрашенные и прозрачные камни встречаются далеко не часто. На заводах, в лабораториях выращивают синтетические кристаллы. Необыкновенные свойства кристаллов.
«Эфиры химия» - Сложные эфиры в природе. R – C = O + R – OH R – C = O +H2O O – H O – R кислота спирт общая формула сложных эфиров. Химические свойства: гидролиз сложных эфиров. Сложные эфиры. Свойства сложных эфиров. Получение нитроглицерина. Сложные эфиры, широко распространенные в природе вещества. Работы выполнил: Мазаев Б. ученик 10 В класса средней школы № 5. Важнейшими представителями сложных эфиров являются жиры. Получение сложных эфиров.
Всего в теме «Химия 10 класс» 59 презентаций