Классификация кислот по строению кислотного остатка |
|
Скачать презентацию |
||
| << Состав кислот | Нахождение кислот в природе >> |
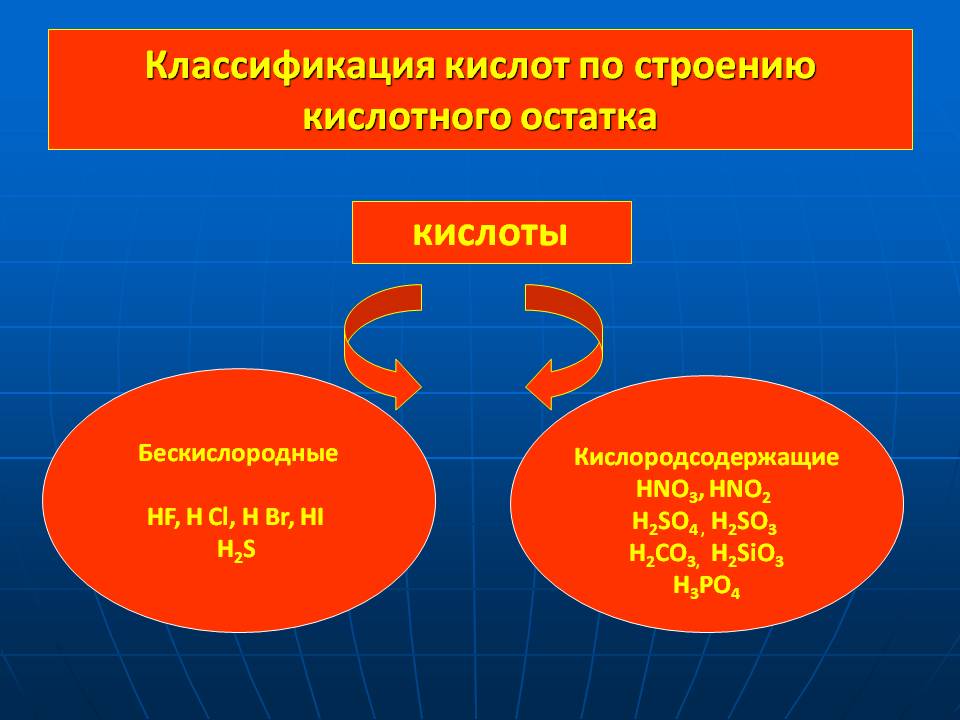
Классификация кислот по строению кислотного остатка. Кислоты. Бескислородные HF, H Cl, H Br, HI H2S. Кислородсодержащие HNO3, HNO2 H2SO4 , H2SO3 H2CO3, H2SiO3 H3PO4.
Скачать презентацию
Химия 8 класс
краткое содержание других презентаций«Классы неорганических веществ» - Соли. Лакмус. Основания. Кислоты. Сколько классов веществ представлено в ряду. Оксиды. Классы неорганических веществ. Экспериментальная задача. Составьте формулы названных солей. Соли в практике человека. Как можно дополнить схему. Если к крапиве неосторожно прикоснуться рукой, ощутишь боль и жжение. От кислот вред или польза. Задачи урока. Соли кальция.
«Оксиды и летучие водородные соединения» - Сколько атомов каждого элемента содержится в данном объёме. H2O. Номенклатура оксидов. Агрегатное состояние оксидов в обычных условиях. Бинарные соединения. Оксиды в природе. Бинарные соединения – оксиды и летучие водородные соединения. Оксиды. Гидриды и летучие водородные соединения. Диоксид углерода CO2.
«Степень окисления» - Определить степени окисления. Окислители. Фтор всегда имеет С.О. (- 1) во всех соединениях. Определите степени окисления элементов. Процесс отдачи электронов атомами, молекулами или ионами называется окислением. Степень окисления. Образовательные результаты. Восстановители. Степень окисления «0» - ноль: 1. Простые вещества: Н2, Са, О2, К… 2. Сложные в-ва (в сумме): Са+2О-2 (+2 – 2 =0). Какие степени окисления у серы?
«Состав и свойства воздуха» - Значение воздуха. Воздух, его состав и значение. Охрана воздуха. Исследования. Химический состав воздуха. Философ Анаксимен. Исследователи и первооткрыватели воздуха. Загрязнение воздуха. Состав воздуха. Загрязнение воздуха деятельностью человека.
«Получение водорода» - Производство минеральных удобрений. Способы получения. Допиши химические реакции. Природный газ. Способы получения водорода. Нагревание. Получение водорода в промышленности. Применение водорода. Получение водорода в промышленности и его применение. Типы реакций.
«Классификация химических реакций» - Реакции соединения. Реакции, которые протекают в двух противоположных направлениях одновременно. Классификация химических реакций. Разложение. Реакция разложения. Реакции замещения. Экзотермические реакции. Решетовская средняя общеобразовательная школа. Химия. Реакции, протекающие без изменения степени окисления. Реакции обмена. Процесс изменения веществ. Характеристика химической реакции. Гомогенные реакции.
Всего в теме «Химия 8 класс» 53 презентации