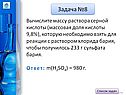
Задачи по химии |
|
Химия 9 класс
Скачать презентацию |
||
| << Уроки химии | Решение задач на смеси >> |
Химия 9 класс
краткое содержание других презентаций«Углерод, соединения углерода» - Устранение жесткости воды. Иллюстративный материал для ответов учащихся. Последствия использования жесткой воды. Влияние курения на развитие плода. Парниковый эффект. Изделия из алмаза. Буры и сверла. Белки. Жесткость воды и способы ее устранения. Кристаллическая решетка графита. Молекула ДНК. Сталактиты и сталагмиты. Значение углерода. Применение соединений углерода: углекислый газ. Влияние курения на внутренние органы.
«Кислород. Озон. Воздух» - Свойства кислорода. Озон и кислород. Получение кислорода. Обобщение. Изучить состав воздуха. Аллотропия. Применение кислорода. Биологическая роль. Решите проблему. Состав воздуха. А.Лавуазье. Кислород. М.В.Ломоносов. Выделение кислорода. Выполните задание. Проверьте ваши ответы. Выполните тест. Лабораторный опыт.
«Характеристика щелочных металлов» - План урока. Проверь себя. Щелочные металлы. Соединения щелочных металлов. Простые металлы. Составьте уравнения реакций. Природные соединения щелочных металлов. Рубидий. Литий. Калий. Закономерности в строении атомов щелочных металлов. Натрий. Франций. Цезий. Общая характеристика элементов главной подгруппы I группы.
«Задачи на смеси по химии» - Цель урока. Работа в парах. Массовая и объемная доли веществ в смеси. Природный газ – смесь газов. Задача на смеси. Нефть – смесь веществ. Морская вода – смесь веществ. Задача на сплавы. Смешали 8кг 18 % раствора некоторого вещества с 12 кг 8 % раствора. Решение задачи. Смеси в повседневной жизни. Решение задач на смеси, растворы и сплавы. Отношение массы основного вещества (m) в смеси к общей массе.
«Элемент водород» - Получение в промышленности. Плохо растворим в воде. t0 кипения = -2530 C t0 плавления = -2590C. Строение атома. Знаете ли вы что… Мыльные пузыри наполненные водородом поднимаются вверх. Нахождение в природе. История открытия и названия. Дейтерид лития – основной компонент заряда водородной бомбы. Изотопы водорода. Водородная сварка и резка металлов. Топливо в двигателях. Синтез метанола. Водород. Химические свойства.
«Метан» - Общее количество метана в атмосфере оценивают в пределах 4600-5000 Тг (Тг = 1012 г). Получение. Источники. Вклад метана в парниковый эффект на Земле составляет уже одну треть. Изменение концентрации метана во времени. В настоящее время концентрация атмосферного метана составляет 1,8 ppm. Метан. Химические свойства. Концентрация метана невелика. Малорастворим в воде, легче воздуха. Время жизни метана в атмосфере 8-12 лет.
Всего в теме «Химия 9 класс» 94 презентации